ウイルス免疫誘導のダイナミズム
和戸川 純
糖たんぱく質のMHC(主要組織適合抗原)は、細胞内に存在する抗原ペプチドを結合して、細胞表面へ発現させる。ヒトのMHC遺伝子は多様で、1万種類を超える。これらの遺伝子が、遺伝子組み換えによってMHCに多型性をもたらす。
また、抗原ペプチドと結合する、MHCのポリペプチド鎖領域で、アミノ酸の著しい入れ換えが起こっている。これによって、MHCがさらに多型になる。
MHC・抗原ペプチド複合体をT細胞の抗原受容体が認識し、多様な免疫反応が引き起こされる。遺伝的に規定されたMHCの多型性によって、一人ひとりが持つMHC分子が異なる。このMHCの相違が、個々人の免疫反応に大きな違いを生じさせる。致死的な病原体との遭遇では、特異免疫を効果的に誘導するMHCを持っているヒトが、生存に有利。子孫を増やす。
「ストレスで抑制される免疫反応」で、MHC・抗原ペプチド複合体を認識する、T細胞の抗原受容体が、無限の多型性を獲得するメカニズムを書いた。抗原を提示するMHCと、それを認識する受容体の両方に限りない多型性が存在する。無限の柔軟性を生み出す免疫系の驚異が、ここにある。
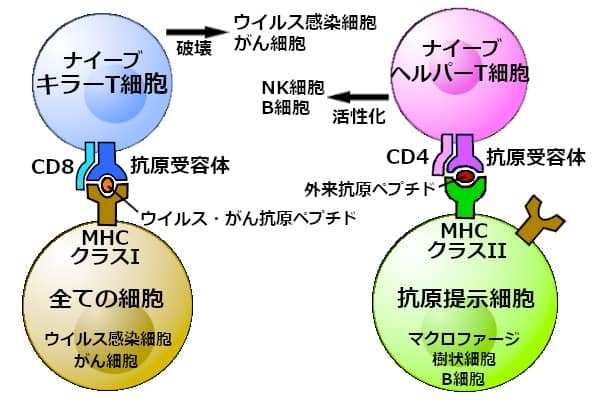
全ての細胞が、MHCクラスI分子を持っている。MHCクラスIは、細胞内に存在する抗原ペプチドを結合して、細胞表面に発現させる。ナイーブキラーT細胞が、糖たんぱく質のCD8で補強された抗原受容体を使って、MHCクラスI・抗原ペプチド複合体を認識する。複合体に結合した細胞は、活性化され、分化し、成熟したキラーT細胞になる。
細胞内抗原には、自己抗原とそれが変異したがん抗原、それに細胞内で増殖したウイルス抗原がある。自己と反応する幹細胞が、胸腺で除かれる。ナイーブキラーT細胞が、正常な自己抗原を提示する細胞に反応することはない。
マクロファージ、樹状細胞、B細胞は、MHCクラスII分子も持っている。これらの細胞は、抗原提示細胞と呼ばれる。細菌などの外来抗原が、抗原提示細胞に取り込まれる。外来抗原は、エンドソーム内で、消化酵素によってペプチドに分解される(「ストレスで抑制される免疫反応」図5)。MHCクラスIIがその抗原ペプチドを結合し、複合体が細胞表面に発現する。
ナイーブヘルパーT細胞が、CD4たんぱく質で補強された抗原受容体を使って、MHCクラスII・抗原ペプチド複合体を認識する。このT細胞が活性化され、分化し、成熟したヘルパーT細胞になる。
成熟したヘルパーT細胞が、抗原特異的な獲得免疫において、司令塔の役割を果たす。ヘルパーT細胞は種々のサイトカインを放出し、NK細胞、キラーT細胞、B細胞などを誘導し活性化する。
キラーT細胞は、ウイルス感染やがん化によって、異常な抗原を産生するようになった細胞を、攻撃する。ウイルス感染におけるキラーT細胞の重要性は、感染細胞の表面に、時間の経過と共に多様なウイルス抗原が現れることから、明らかだ。
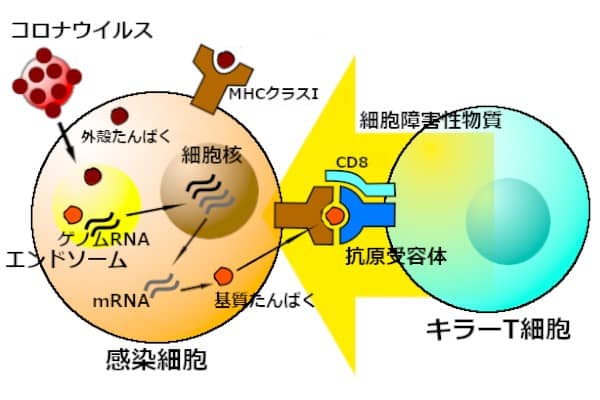
スパイクたんぱく質のような、ウイルス表面の抗原だけではない。成熟したウイルス粒子ではウイルスの外殻で隠されている、核たんぱく質由来の抗原も感染細胞の表面に現れる。MHCに結合したそのようなウイルス抗原ペプチドを、キラーT細胞が認識する。感染細胞が成熟したウイルス粒子を放出する前に、細胞障害性物質を放出して感染細胞を破壊する。
臓器移植において、他人のMHCを有する臓器が移植される。そのMHCを非自己と認識したキラーT細胞が、臓器を攻撃し排除してしまう。臓器移植において、免疫抑制剤の投与が必要な理由だ。
自然界で臓器移植は行われないが、人為的に作られた異常に対しても、免疫系は確実に反応する。もっとも、この反応は、人間には歓迎できない反応だ。
ヘルパーT細胞は、抗原特異的なB細胞も誘導する。T細胞表面で抗原ペプチドを認識するT細胞受容体。それと同じ特異性を有する、B細胞によって産生されたたんぱく分子が、抗体だ。B細胞から血中へ放出された抗体が、標的の病原体を攻撃する。抗体のクラスにはIgG、IgM、IgA、IgD、IgEがある。コロナウイルス感染との関連では、IgG、IgM、IgAが重要になる。
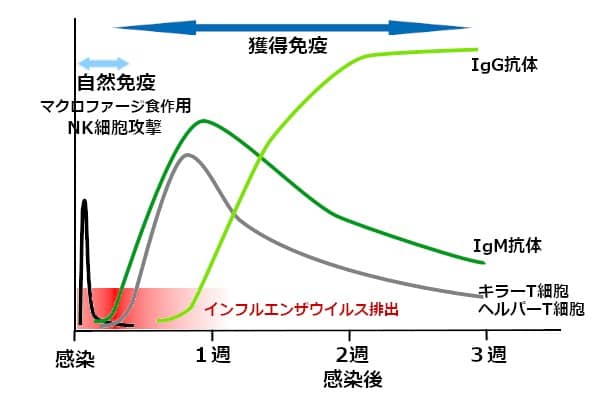
マクロファージとNK細胞が主役を演じる、感染初期の自然免疫が、ウイルス感染と同時に発動される。不活化ワクチンのように、抗原が短時間で一掃されれば、自然免疫の持続期間は1日程度だ。
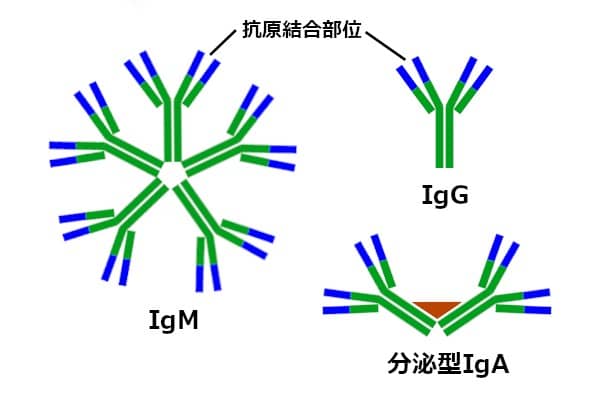
初めて遭遇したウイルスに対する、獲得免疫が成立するまでに、数日ほどかかる。1週間程度でヘルパーT細胞とキラーT細胞の活性が、ピークに達する。それに伴ってB細胞が活性化され、抗原に対する結合力が弱い、IgM抗体産生のピークが、最初に来る。感染から1週間後の頃だ。IgMは、Y字型単量体が5個集まって形成されている(5量体)。
単量体の先端に2つある、抗原結合部位の結合力は弱い。しかし、抗原結合部位が10か所もあるために、ウイルスを凝集させやすい。ウイルスを取り込んだIgMが、補体を結合し、ウイルス凝集塊をマクロファージに取り込みやすくする。また、IgMと補体の共同作業で、ウイルス感染細胞を溶解する。マクロファージを活性化する作用もある。
感染後期(1週間目頃から)になると、強い結合力を有するIgG抗体が産生される。血中の主要な免疫グロブリンがIgGで、75~80%を占める。IgG抗体は、コロナウイルスのスパイクたんぱく質に強く結合し、ウイルスの感染能を奪ってしまう。
自然免疫が減退してから、獲得免疫が有効になるまでの間に、1~2日程度の空白期間がある(図3)。この間に、ウイルスが爆発的に増える。
生体内では、古い細胞や機能が異常な細胞が、アポトーシス(自殺)などで自然に死んでいる。同時に、死んだ細胞を埋め合わせるために、細胞増殖によって新しい細胞が供給されている。ウイルス感染によって死亡する細胞の数が、この自然の治癒力の範囲内に収まっていれば、発症はしない。無症状のままで、ウイルスを体外へ排出することになる。組織や器官の損傷が、自然治癒力を超えたときに発症する。
インフルエンザウイルス感染においては、感染後1日目で発症する。ウイルス排出のピークが2日目に来て、3~4日目に症状が最も重くなる。ウイルスの排出が1週間程度続く。
新型コロナウイルスの潜伏期間は長く、3日に渡る。咽頭スワブの検査では、症状が出る1~2日前に、咽頭から大量のコロナウイルスが排出されることが、分かった。このために、発症前の感染者が、重要な感染源になる。また、ウイルス排出は、インフルエンザウイルスよりも長く続く。
コロナウイルスとの戦いにおいては、IgA抗体に注目する必要がある。
IgA産生B細胞が、消化管や気管の粘膜上皮の下に集合している。ここで産生されたIgAは、酵素からIgAを守る、上皮から分泌された糖たんぱく質を結合する。2量体になった分泌型IgAが、粘液へ放出される(図4)。分泌型IgAは、唾液、鼻汁、涙液、気道粘液、消化管粘液、胆汁、乳汁などに含まれている。
初乳に高濃度で含まれる分泌型IgA抗体が、乳児の腸管で感染防止の重要な役割を果たす。
初乳には多数の免疫細胞や大量のサイトカイン、免疫グロブリンが含まれていて、乳児体内へ移行する。これらが、乳児の免疫系確立において重要な役割を果たす。進化によって準備された、生命維持機構だ。
分泌型IgA抗体が、最前線でからだをウイルスから防御する。獲得免疫において、この抗体の産生が不十分ならば、ウイルスは何度でも最初の防御壁を突破する。
新型コロナウイルスで再感染が注目されている。粘液中の分泌型IgA抗体が少ない感染者では、体液性の免疫が亢進していても、コロナウイルスが粘膜上皮細胞へ侵入するのを、防ぐのが難しい。これが、再感染が起こる理由の1つになる。
分泌型IgA抗体の検出は、血中抗体の検出よりも困難なので、新型コロナウイルスとの関連では報告されていない。
多くのワクチンは、注射によって皮下や筋肉内に接種される。このようなワクチン接種では、分泌型IgAの産生を十分に誘導できない。新型コロナウイルスでは、自然感染と同じように粘膜を経由して免疫を誘導する、経鼻接種が望ましい。
私は、以前、分泌型IgAの研究を行ったことがある。エンテロウイルス(腸管ウイルス)との関連での研究だった。ポリオウイルスがエンテロウイルスに含まれる。エンテロウイルスもコロナウイルスも、遺伝情報が書き込まれている核酸はRNA。これに対して、ヒトの遺伝情報はDNAに書き込まれている。RNAは、遺伝情報から機能性たんぱく質が作られる過程で、情報伝達のメッセンジャーとして使われる。
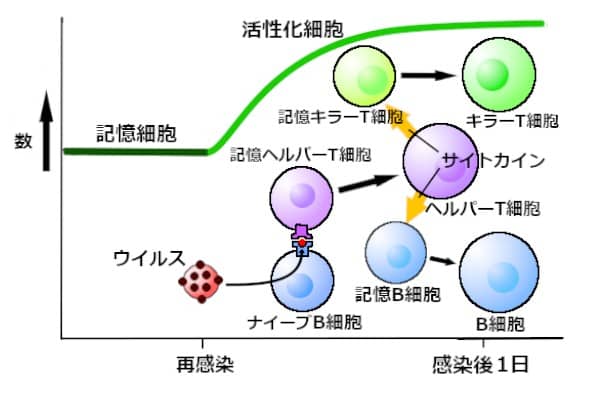
獲得免疫によってウイルスが排除されると、抗原刺激になるウイルスが存在しなくなる。活性化されていたT細胞やB細胞は、2週間程度で死滅する。
活性化された免疫細胞の一部が、細胞分裂を停止して休止期に入る。これが免疫記憶と呼ばれる現象。記憶T細胞や記憶B細胞が、長い間体内に存在し続ける。記憶細胞は、10年以上から数十年も生きながらえる、と考えられる。
再感染が生じると、ナイーブB細胞やマクロファージが、ウイルス抗原を記憶ヘルパーT細胞に提示する。活性化されたヘルパーT細胞が急速に増える。ヘルパーT細胞が放出する種々のサイトカインが、他の記憶細胞からキラーT細胞やB細胞を誘導する。
活性化された免疫細胞の数が、防御に十分になるまでに1日もかからない。これによって、ウイルスに、爆発的に増殖する時間的な余裕を与えない。自然感染でもワクチン接種でも記憶細胞が生まれるが、記憶細胞の数が少なければ、再感染で発症する可能性がある。
新型コロナウイルスの感染で、疑問が提出されている。PCR検査で、陽性から陰性になった感染者が、再度陽性になることだ。
これは次のように考えられる。感染細胞の数が減ったり、感染細胞が多くても、細胞内でのウイルスの増殖速度が減少すれば、PCR検査が陰性に転じる。ストレスが加わって免疫力が低下すると、再度ウイルス増殖が加速し、PCR検査で陽性になる。免疫力の低下が、潜伏していたヘルペスウイルスの増殖を助け、帯状疱疹を発症させることが、よく知られている。
新型コロナウイルスでは、無症状の感染者が多い。感染細胞の数が少なければ、器官が大きな損傷を受けることがない。無症状になる。ウイルスの増殖速度が遅ければ、感染した細胞の代謝が、決定的な損傷を受けることがない。ウイルスを長期に渡って排出し続けながらも、無症状の感染になる。
以上の例では、抗原刺激になるウイルスの産生が十分ではなく、免疫が誘導されにくいと思われる。
新型コロナウイルスとの関連で、ワクチンを熱望する意見が多い。ワクチン接種は人為的なウイルス感染だ。新型コロナウイルスの感染を極力避ける努力をしながら、ワクチンを待望することには矛盾がある。
病原性の弱いウイルス(生ワクチンの場合)をワクチンに使うことが、ワクチン接種を肯定する論理になる。これには2つの問題がある。弱毒で安定したウイルス株の樹立が、困難なのだ。また、弱毒であることはウイルスの増殖力が低いことを意味し、抗原になるウイルスの産生量が少ない。十分な免疫を獲得できるかどうかが、問題になる。
生ウイルスワクチンは、自然感染するウイルスと同様に、免疫系を全体的に活性化する。細胞性免疫も液性免疫も誘導する。 しかし、不活化ワクチンで誘導される免疫反応には、限界がある。B細胞が中心的な役割を果たす、液性免疫が惹起され、ウイルスに対する抗体が産生される。不活化ウイルスは細胞内で増殖しないので、感染細胞の表面に現れるウイルス抗原を標的にした、細胞性免疫の引き金が引かれにくい。
不活化ワクチンの弱点は、抗原刺激の持続期間にも現れる。生ワクチンでは、弱毒ウイルスが体内で一定の期間増殖を続け、免疫を亢進させる。抗原刺激のブースター効果が期待される。不活化ワクチンは、一度きりの抗原刺激になる。
免疫を広範に誘導する生ワクチンの開発が重要だが、効果にブレがない生ワクチンの大量生産が困難だ。合成ペプチドを含む不活化ワクチンには、その問題がない。ACE2との結合に関わっている、スパイクたんぱく質のポリペプチドならば、大量生産が容易。それを免疫誘導に効果がある基質に乗せて接種する。
新型コロナウイルスの感染者のうちで、80%強が無症状者になる、と示唆されている。新型コロナウイルスの抗体検査は始まったばかりで、特定の集団内の陽性率に結論を出すことができない。しかし、アメリカにおける今までの抗体検査によると、PCR検査で陽性と判断された感染者の、10~70倍の人々が、コロナウイルスに感染したことを予想できる。日本で実施された小規模検査で、この倍率が数百倍になった例がある。
100倍以上が正しい倍率かもしれない。ウイルス核酸を検出するPCR検査では、感染から1週間前後の、ウイルス排出が最大になった時期にしか陽性と判断されない。検査がこのタイミングからはずれると、陰性になってしまう。抗体検査では、1週間以降の長期に渡って陽性と判断される。
60%の人々が免疫を獲得すれば、ウイルス感染が収束する、と一般に言われる。40%という主張もある。感染の連鎖を考えれば、集団の5割程度が免疫を得れば、感染の広がりが止まるはずだ。
各国の感染状況を見ると、新型コロナウイルスでは、特定の集団における感染拡大が明確になってから、1~2か月後に新規感染者数がピークに達する。
1~2か月で、感染が拡大する範囲にいる人々(集団)の5割程度が、免疫を獲得して感染が収束する、と推測することが可能だ。
国全体では、ウイルスが広がらなかった、ウイルスに感受性のある集団が多数残っている。第2波でこのような集団に感染が広がる。
新型コロナウイルスに関しては、免疫を獲得する人々の割合が、5割よりもずっと少なくても、感染が止まるはずだ。
各国の疫学調査で、20歳以下の感染者が少ないことが知られている。特に、子供の感染者がまれだ。アメリカの調査では、PCR陽性の4万4672人に占める、19歳未満の若年者の割合が、2%にとどまった。死者1023人に子供が含まれなかった。感染が爆発してロックダウンされた武漢や、ほとんど規制をかけず、休校もしなかったスウェーデンで、同じような知見が得られている。
自然免疫能が若年者で高く、コロナウイルスに抵抗性を示すと思われる。子供たちが、免疫獲得者と同じような集団の防御壁になる。休校は明らかに見当違いだ。
ACE2の発現量が、年齢とともに増加し、女性よりも男性のほうが、発現密度が高い傾向がある、と報告されている。その発現量は、運動や喫煙によって上昇する。心疾患、高血圧、慢性閉塞性肺疾患などの持病を持つ人々も、肺のACE2発現量が上昇するという。自然免疫能が高いだけではなく、ACE2の発現量が少ないことも、子供の感染者が少ない理由になる。
上述したように、新型コロナウイルス感染において、感染率も死亡率も女性のほうが低い。その差は子供ほど明確ではないが、感染対策において疫学的な考慮をするときに、重要な意味を持つ。
私たちの祖先は、38億年前に、地球の温かい原始の海の中で誕生。細菌のような単細胞生物だった(エッセイ2「絶滅をバネに進化する生物」)。それらの単細胞生物が協力し合い、集団として生き延びるようになり、多細胞生物が生まれた。
今でも、私たちのからだは、基本的には単細胞集団の形を取っている。単細胞である卵子と精子が合体し、個体を形成する60兆個の細胞を生み出す。
この細胞集団は、外部から侵入して自分たちの生存を脅かす、細菌やウイルスなどを排除する機能を獲得した。それが免疫だ。
「クローン選択説」において、集団構成細胞である自己と、外部から侵入する非自己の微生物を判別する能力が、理論化された。がん細胞は、仲間の細胞との協力関係から飛び出して、自分勝手に非自己のように振る舞う。NK細胞やキラーT細胞が、このような造反者を激しく攻撃する。
当評論では触れていないが、免疫系には、免疫を抑制する機能も存在する。抑制性T細胞を中心にしたこの機能が、活性化機構と同じように極めて複雑だ。複雑な2つの機能のバランスの上に、生体のホメオスタシスが維持されている。
ここまで書いたように、ウイルスと免疫系の戦いは千変万化する。免疫反応が、感染において誰でも同じように発動されるわけではない。
個体によって遺伝子が異なるために、遺伝子産物が関与する免疫活性化の程度が、個々人で異なる。細胞性免疫が活性化されても、液性免疫が抑制される場合がある。その逆の場合もある。同一の個体でも、生体内外の環境が、時間とともに変化するので、同じウイルスに対して異なる反応をする。
スパイクたんぱく質に対する、IgA抗体やIgG抗体が、大量に産生される個体では、抗体がウイルスの侵入を効果的にブロックする。抗体検査で高い抗体価が検出されても、侵入とは関係のないウイルス基質の抗原ペプチドに対する抗体ならば、感染を防御できない。
遺伝子で規定された、免疫反応のこのような多様性によって、不適格者が切り捨てられる。細菌やウイルスに対する、防御力の高い個体の子孫が増える。
以上の進化は、宿主の進化だが、ウイルスを含む微生物も、生き残りのために進化する。ヒトに初めて感染すると、人のからだが増殖にとって都合がよければ、爆発的に増殖する。その結果、宿主が死亡する。自分の生き残りのためには、宿主を生かしたほうがいい。微生物は、宿主を殺さない方向へ進化する。最終的には、宿主の生存を積極的に助けるようになる。
腸内に100兆個の細菌が定住。栄養消化と免疫系の活性化に貢献している。細胞内器官であるミトコンドリアは、別の生物だ。地球上に酸素が増え始めた20億年ほど前に、私たちの祖先の単細胞生物へ入り込んだ。酸素をエネルギーに変換するミトコンドリアのおかげで、私たちは大気中で生きることができる。
ヒトが持っているDNA(ゲノム)は、ヒトのものと思いがちだ。ところが、30億対の塩基から成るDNA鎖の、なんと34%もの領域のDNAが、ウイルス由来なのだ。
遺伝情報が書き込まれている遺伝子部分は、DNA鎖の2%しか占めていない。残りの98%の領域が、ノンコーディングあるいはジャンクと呼ばれる領域。ノンコーディング領域は、遺伝子から機能性たんぱく質が作られる過程で、遺伝子の発現を助けている。機能の多くが、まだ未知だ。
ノンコーディング領域に、DNAの切り出しと翻訳を担っている、イントロンが存在する。ウイルス由来のDNAが、イントロンに組み込まれている。遺伝子は極めて保守的だが、環境が激変しても、ウイルスDNAを含む、イントロンのおかげで生物は生き延びることができる。
細胞の増殖を助けるある種の増殖因子DNAも、もともとはウイルスだった。さらに、レトロウイルスの中には、宿主の遺伝子を運搬するものがある。まるで宅急便だ。