ストレスで抑制される免疫反応
和戸川 純
バーネットが、現代免疫学の基礎になる理論「クローン選択説」を、1959年に提唱した。バーネットは、1960年に、免疫学分野で初めてノーベル賞を受賞。バーネットと私の出会いを、エッセイ28「天才を育てる楽しみ」に書いた。
「クローン選択説」の提唱から約60年が経った。60年の間に、情報科学(拙著「サイバー世界戦争の深い闇」)や宇宙科学(拙著「無から湧き出る宇宙」)が、飛躍的に発展した。しかし、免疫学分野には、まだ余りにも多くの謎が残されている。免疫の研究者が、今までなまけていたわけではない。
地球上に生物が誕生してから38億年。数多くの絶滅があった(エッセイ2「絶滅をバネに進化する生物」)。生き残りのために、生物のからだの中で巧妙な策がねられた。そのうちの1つが、外敵に対する防御網である免疫系の構築だった。
進化の過程で遭遇したことのない、病原体が宇宙から飛来しても、免疫系はしっかりと対応できる。この無限の柔軟性が、生存には大きなプラスになる。しかし、免疫の研究をとても困難にしている。科学的な実証において必須な、再現性のある実験結果を得るのが難しいのだ。
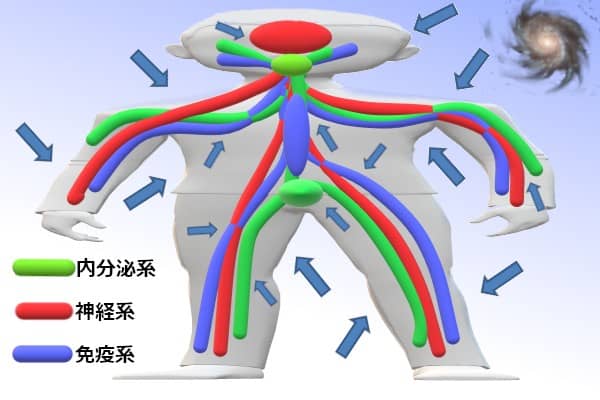
さらに、生体の恒常性(ホメオスタシス)を維持するために、免疫系は、神経系やホルモンを産生する内分泌系と、密に協力し合っている。これが解析をさらに難しくする。
神経の末端が、網の目のように張り巡らされたリンパ節。免疫系への刺激が脳へ伝わり、脳への刺激が免疫系へ伝わる。極めて高度なオンタイムのフィードバック機構だ。このフィードバックは動的で、一瞬も休むことなく変化している。これを試験管内(in vitro)の実験で再現することが、不可能なことが、生体内(in vivo)の環境を反映させた免疫の実験を、とても難しくしている。
生体の外部や内部の要因によって、いろいろなストレスが生じる。ストレスによって自律神経が亢進し、交感神経が刺激される。精神的なストレスが、神経伝達物質の産生を高める。刺激を受けた副腎皮質などの内分泌器官が、コルチコイドなどのステロイドホルモンを放出する。ステロイドホルモンは代謝を亢進させ、血糖値の上昇、水分の保持、気分の高揚などの作用を示す。
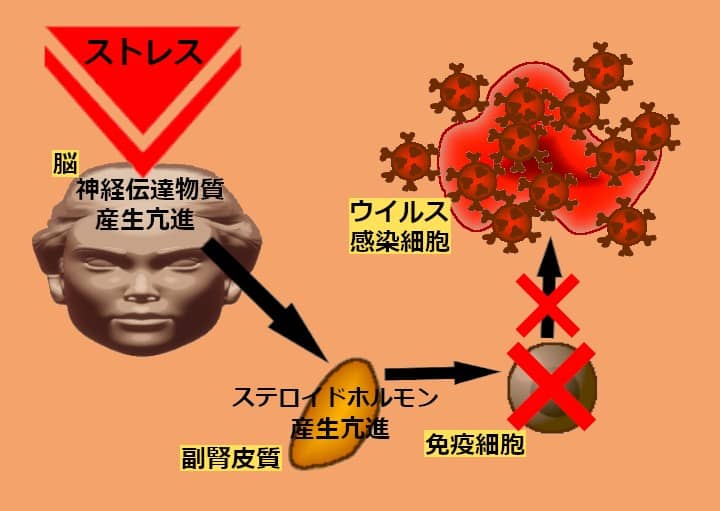
以上の反応は、ストレスを与えている環境から逃げるための、生体反応だ。これは防御反応の一種だが、ステロイドホルモンには抗炎症作用がある。炎症は、免疫細胞が集合することによって生じる。炎症の抑制が、免疫細胞の活性低下や死につながり、免疫反応の抑制をもたらす。
体内に入った病原体を最初に捕獲し、病原体の抗原を処理して他の免疫細胞へ提示するのが、樹状細胞やマクロファージ(貪食細胞)の役割。ストレスによって、樹状細胞の抗原提示能やサイトカイン産生能が低下する。これによって、特異的な免疫反応の中心に存在するT細胞が、抑制されてしまう。
新型コロナウイルスの感染対策として、街や国がロックダウンされた。住民は、感染が広がった街から逃げすことができない。家族全員が小さな部屋に閉じ込められ、親しい人に会えず、楽しいエンタメに行けず、運動ができず、食べ物を十分に食べられない。運動不足、睡眠不足、栄養失調、困窮が、精神的なストレスを増大させる。住民の免疫力低下の研究がもし可能だったならば、免疫の専門家が驚ろく結果を得られたはずだ。
ストレスによる免疫力の低下が、コロナウイルス感染者の症状を悪化させたことは、間違いない。がん細胞への免疫系の攻撃が弱まるので、がん細胞の増殖によるがんの重症化もあった。
ストレスレベルが低いグループに比べて、ストレスレベルが高いグループでは、がんの発症率が11%上昇する、という国立がん研究センターの報告がある。新型コロナウイルス感染下での国家規模のロックダウンは、長期にわたるより過酷なストレスを人々に与える。がん発症の上昇率は、11%を超えている可能性が高い。
ロックダウン下での死者の中には、治療が手薄になったことで命が経たれた、他の疾患の患者が含まれる。ストレスは、心臓麻痺や脳梗塞などの発生を増大させる。ストレスと困窮が原因になって、家庭内暴力と自殺が増える。大きな犠牲を伴う、ロックダウンのような極端な政策を取ることには、最大限の注意が必要だ。
精神状態が免疫系に影響を与えることは、ストレスとは逆の「笑い」の研究からも知られている。笑うだけでステロイドホルモンの産生が減少する。神経ペプチド(免疫機能活性化ホルモン)の産生が脳で増大し、神経ペプチドが全身へ供給される。それによって、ウイルス感染細胞やがん細胞を攻撃する、NK細胞(ナチュラルキラー細胞)が活性化される。
細胞の機能に影響を与えるたんぱく質に、種々の免疫細胞が産生するサイトカインがある。インターフェロンやインターロイキンなどのサイトカインの産生が、神経ペプチドによって制御され、マクロファージやT細胞が活性化される。がん、リウマチ、糖尿病、心筋梗塞などの改善に対する、笑いの効果が著しい。
多くの病原体が、硬く乾燥した角質から成る皮膚ではなく、やわらかく湿った粘膜を生体への侵入口にしている。眼窩、耳、唇、鼻孔、気管支、肺、消化器、生殖器などの表面は、粘膜上皮細胞によっておおわれている。
この細胞の表面に、アンジオテンシン変換酵素2(ACE2)が、発現している。ACE2の役割は、細胞の代謝に関わることによって、細胞増殖の調節、血管拡張、臓器の保護などを行うことにある。ACE2は、心臓、腎臓、睾丸、肝臓、膵臓、脳などの血管内皮細胞の表面にも、発現している。

コロナウイルスの表面に、スパイクたんぱく質が突き出ている。このスパイクたんぱく質を、上皮細胞のACE2に結合させて生体へ侵入する。インフルエンザウイルスは細胞表面のシアル酸に結合して、細胞内への侵入を図るので、コロナウイルスとは侵入法がやや異なる。
ニコチンが、気道の上皮細胞のACE2発現を助ける。糖尿病や高血圧の治療に使われる、アンジオテンシン系の治療薬が、肺のACE2を増加させる。喫煙者や、これらの疾患の患者が、新型コロナウイルスで重症化しやすい理由だ。急性腎不全を起こす、新型コロナウイルスの患者が増えているが、腎臓の細胞にはACE2が多いことが知られている。
多様な器官の細胞にコロナウイルスの侵入口があるために、全身性の症状をもたらす。ただし、器官が変われば、細胞表面のACE2の発現量が異なる。細胞内でコロナウイルスを増殖させるメカニズムにも、器官毎に違いがある。新型コロナウイルスによる器官別の損傷の程度については、今後の解析を待つしかない。現在までのところ、風邪に認められる症状や肺炎のほかに、下痢、嗅覚・味覚障害、腎障害の発生が知られている。
動物の進化は、共生が可能な微生物を、生存のために使う方向へ進んだ。ヒトの腸管には、約1000種類、100兆個もの腸内細菌が常在している。 多くの細菌が、食物の消化を助けたり、免疫系の亢進に関わるなどして、宿主の生存に貢献している。
そのうちの1つに乳酸菌がある。乳酸菌の代謝産物の乳酸やピルビン酸が、粘膜上皮細胞に取り込まれる。これらの代謝産物が、上皮細胞の下に存在する、莫大な数のマクロファージ、好中球、樹状細胞に受け渡され、細胞を活性化する。
活性化されたマクロファージが、上皮細胞の間から腸管内へ突起を伸ばす。腸管内に存在する、病原性のウイルス、細菌、カビ(真菌)などの微生物を取り込み、エンドソームで消化する。あるいは、細菌の細胞膜に穴を開けるたんぱく質を放出して、細菌を破壊する。
腸管が重要な免疫器官になっている。粘膜上皮細胞を有する呼吸器系のような他の器官にも、腸管に準じた免疫機構が存在する。
粘膜や皮膚が障害を受けて、病原体が体内へ入り込んでも、マクロファージがまず最初に病原体を排除する。
マクロファージの役割は、単に病原体を排除するだけではない。細胞間の情報伝達物質である、50種類以上のサイトカインを放出し、NK細胞(ナチュラルキラー細胞)を活性化する。NK細胞は、がん細胞やウイルス感染細胞を攻撃。
サイトカインは、免疫細胞間での情報伝達ばかりか、脳に到達して視床下部を刺激し、体温上昇をもたらす。体温上昇が免疫系の亢進に貢献する。感染で発熱して、解熱剤を使うことには注意が必要だ。
マクロファージは、がん細胞やウイルス感染細胞の排除以外の仕事も、になっている。細胞の破片などの老廃物を取り込む。莫大な数の細胞が常時死んでいるので、体内をクリーンにするマクロファージの役割は、極めて重要だ。
ここまでが、病原体に非特異的に対応する自然免疫で、生体の初期防御をになっている。
分子量が大きいたんぱく質または多糖類、あるいはその複合体が、免疫系によって認識される抗原になる。微生物やがん細胞だけではなく、食物やからだを構成する物質も、抗原になり得る。各抗原に特異的な構成成分が、抗原ペプチド(抗原決定基=エピトープ)で、1~6個の単糖、または5~8個のアミノ酸残基で構成されている。各抗原に特有なこの小さな立体構造が、一つの抗原内に多数存在し、免疫細胞によって認識される。
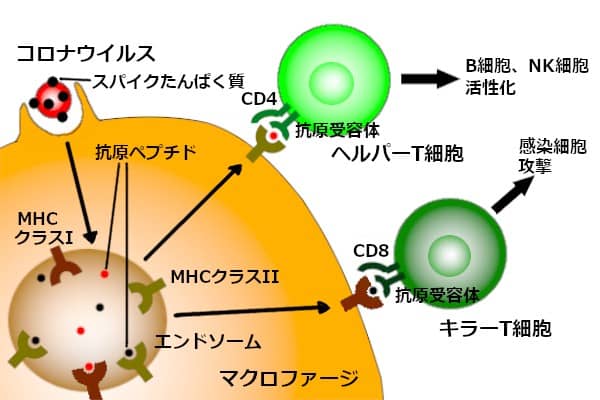
マクロファージは、取り込んだ微生物を消化してから、抗原ペプチドを細胞表面に発現させる。それが、抗原ペプチドに特異的な抗原受容体(T細胞レセプター)を表面に持っている、ナイーブT細胞(未成熟なT細胞)へ提示される。T細胞サブグループ間で、極めて複雑な反応が引き起こされるが、ここでは省略する。
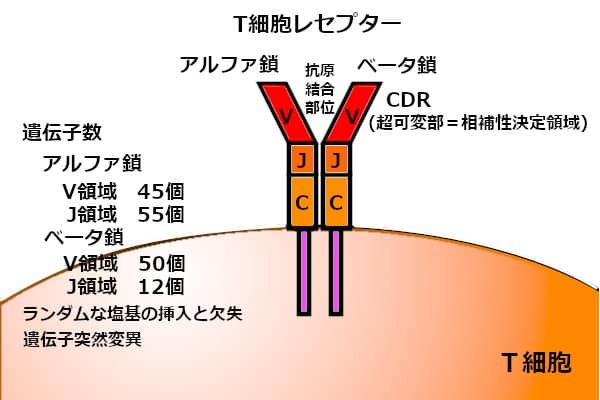
宇宙からの侵入者にも対応できる、免疫系の柔軟性。抗原を認識する、抗原受容体によって担われている。
受容体を作り上げる遺伝子は、上図のV領域とJ領域の間に存在するD領域にもある。これらの遺伝子の再構成(ゲノム編集)によって形成される、受容体の種類は、300万に達する。ランダムな遺伝子の再構成だけで、300万種類の抗原特異性を有する、T細胞集団が生み出される。
それだけではない。遺伝子情報は、DNA2重らせんに書き込まれている。アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類の塩基が、A-TとG-Cの30億対のペアを作って並んでいるのが、DNA鎖。上図の遺伝子を構成する塩基に、別の塩基がランダムに挿入されたり、構成する塩基に欠損が生じたりする。塩基の並び方が変わる、突然変異も生じる。その結果、T細胞は、集団として無限の多様性を獲得する。あらゆる敵を攻撃できる能力だ。
しかし、一瞬で無限に多様なT細胞が誕生することは、あり得ない。新しく出会ったウイルスなどに対して、1週間程度で獲得免疫が成立する。一瞬ではないが、極めて短期間のうちに、あらゆる侵入者に対応できる能力を、集団として持っている。
抗原受容体の特異性は、最初から厳密である必要がない。無限に多様な受容体を持つT細胞集団から、標的だけを正確に攻撃するT細胞が選択される、巧妙なメカニズムが存在する。
標的になるウイルスの抗原ペプチドとの結合が、最初はゆるくてもかまわない。標的抗原との繰り返しの接触によって、より特異的な受容体を持つT細胞が選択され、増殖する。最終的に、極めて特異的な免疫が成立する。
新型コロナウイルスは、地球上の生物だ。どのように変異しても、免疫系は容易に対応できる。
あらゆる敵を攻撃できる能力は、自分自身も攻撃することを意味する。敵と味方を判別できなければ、自らを殺してしまう。自己と非自己を認識する、免疫系の巧妙なメカニズムを理論化したのが、バーネットだ(「クローン選択説」)。
自己・非自己の認識で中心的な役割をになうT細胞。骨髄の造血幹細胞に由来する。山のものとも海のものともつかない幹細胞を、生存に必須なT細胞に変えるのが、胸腺の役割だ。この胸腺が、人目を引かない。見かけが地味なだけではなく、高齢化に伴って縮退してしまう。
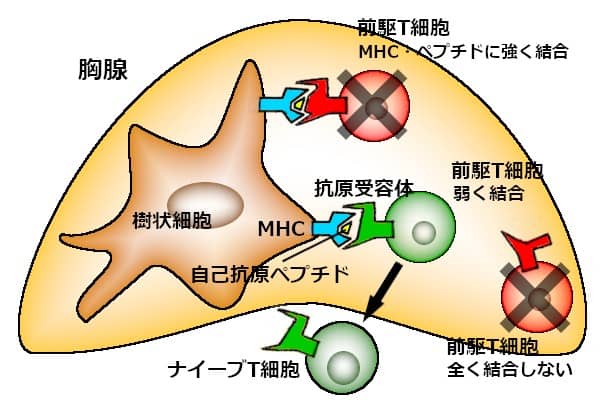
胸腺へ入った幹細胞が、まず前駆T細胞へ分化する。この前駆T細胞が選別の対象になる。
細胞内に存在する抗原ペプチドを、細胞表面へ発現させるのが、MHC(主要組織適合抗原)と呼ばれる糖たんぱく質だ。胸腺の樹状細胞の表面に、MHCに結合した自己の抗原ペプチドが存在している。そのMHC・自己抗原ペプチド複合体に、前駆T細胞が、抗原受容体を使って結合する。
複合体への結合が極めて強い前駆T細胞は、自己を攻撃する成熟T細胞になるので、アポトーシス(自殺)によって死滅する。MHC・自己抗原ペプチドに全く反応しない前駆T細胞も、活性化されずに死滅する。MHCを認識するが、自己抗原ペプチドは認識しない、複合体との結合が弱い受容体を持っている前駆T細胞だけが、生き残る。
生き残る前駆T細胞は、胸腺へ流入した幹細胞の2%しかない。生体が置かれている環境は余りにも厳しく、免疫系にとっては、壮大な無駄は覚悟の上だ。
生き残った前駆T細胞が、胸腺内でナイーブT細胞へ分化し、血流中へ流れ出る。
自己の抗原ペプチドに反応する幹細胞が、胸腺で生き残ることがある。自己抗原がナイーブT細胞へ提示されると、自己反応性T細胞が活性化され、自己免疫疾患が発症する。
自己免疫疾患には、リウマチ、エリテマトーデス、バセドウ病、シェーグレン症候群、橋本病、クローン病、1型糖尿病など、多様な病態がある。からだのいろいろな器官が障害を受けることが、その理由だ。
胸腺の機能は、加齢とともに低下する。自己免疫疾患は、高齢者に多発する傾向がある。
年齢の要因を除くと、罹患率の男女差が圧倒的だ。各疾患の発症率は、女性のほうが2~10倍も高い。自己免疫疾患の多発と女性の長寿との関連について、いろいろな説がある。女性の免疫能が男性を上回っているために、副作用としての自己免疫疾患が発症する、というのが最も素直な理解だ。
致死的な疾患である感染やがんにおいて、女性のほうがより効率的に、病原体やがん細胞を体内から排除している。武漢での新型コロナウイルスの疫学調査によると、男性の死亡率が2.8%だったのに対して、女性の死亡率は1.7%だった。感染が爆発したイタリアでも、男性の死亡率10.6%に対して、女性は6.0%だった。同種のコロナウイルスであるSARSでも、香港での調査によると、男性の死亡率が50%高かった。